Παράγοντας διέγερσης αποικιών κοκκιοκυττάρων-μακροφάγων (GM-CSF)
Ο GM-CSF βοηθά στην προσέλκυση και ωρίμανση αντιγονοπαρουσιαστικών κυττάρων (DC) οδηγώντας σε αποτελεσματικές αντιγονοειδικές ανοσολογικές αποκρίσεις. Για τον λόγο αυτό χρησιμοποιείται σαν ανοσοενισχυτικό σε κλινικές μελέτες εμβολιασμού με καρκινικά αντιγόνα.
Σαν μονοθεραπεία ο GM-CSF χρησιμοποιείται στην αντιμετώπιση μελανώματος σταδίου III και IV. Χρησιμοποιείται επίσης, όπως και ο G-CSF, για την κινητοποίηση αίματος (blood mobilization) για μεταμόσχευση, αλλά και για την αποκατάσταση της μυελώδους σειράς μετά από χημειοθεραπεία.
Παθητική μεταφορά Τ λεμφοκυττάρων (Adoptive T cell therapy)
Η χορήγηση αντιγονειδικών Τ λεμφοκυττάρων, CD8 ή CD4, μετά από ex vivo ανάπτυξη και κατάλληλη διέγερση σε ασθενείς στους οποίους έχει προηγηθεί αφαίρεση/μείωση των ενδογενών λεμφοκυττάρων (lymphodepletion), με παράλληλη χορήγηση αυξητικού παράγοντα για τα Τ λεμφοκύτταρα (IL-2) αποτελεί μία υποσχόμενη προσέγγιση για την επαγωγή επίκτητης αντικαρκινικής ανοσολογικής απόκρισης , η οποία μέχρι σήμερα έχει δείξει σε κλινικές μελέτες σημαντική αποτελεσματικότητα εναντίον του μελανώματος. Παραλλαγές της μεθόδου βρίσκονται υπό έρευνα για πιθανή εφαρμογή και σε άλλους τύπους καρκίνου.
Φυσικά φονικά λεμφοκύτταρα (ΝΚ)
Τα ΝΚ κύτταρα είναι σημαντικά για την άμυνα του οργανισμού ενάντια σε ιικές μολύνσεις και νεοπλασματικές εξαλλαγές, μέσω κυτταρολυτικής δράσης και έκκρισης ανοσορυθμιστικών παραγόντων. Τα ΝΚ κύτταρα παράγουν διάφορες ανοσορρυθμιστικών κυτταροκίνες (IFN-γ, GM-CSF, TNF-α κ.ά.) και χημειοκίνες (chemokines), έχουν άμεση κυτταροτοξική δράση ενάντια σε μολυσμένα με ιούς, λευχαιμικά ή άλλα καρκινικά κύτταρα, καθώς και εξαρτώμενη από τα αντισώματα κυτταροτοξικότητα (antigen-dependent cellular cytotoxicity, ADCC), μέσω του υποδοχέα FcγRII (CD16), ο οποίος δεσμεύει ειδικά το Fc τμήμα του αντισώματος. Επίσης αλληλεπιδρούν άμεσα (μέσω επιφανειακών υποδοχέων) με Τ λεμφοκύτταρα, αλλά και δενδριτικά κύτταρα κ.ά. Η δυνατότητά τους να παράγουν κυτταροκίνες, σε συνδυασμό με την κυτταροτοξική τους δράση, τα καθιστούν σημαντικά τόσο για τη μη ειδική ανοσία, όσο και για την ρυθμιστική τους επίδραση στην ειδική ανοσολογική απάντηση.
Η κυτταρική θεραπεία με ΝΚ κύτταρα υπήρξε ιδιαίτερα υποσχόμενη για την ανοσοθεραπεία του καρκίνου εδώ και τρεις-τέσσερεις δεκαετίες. Παρόλα αυτά, μέχρι σήμερα μέτρια κλινική επιτυχία έχει επιτευχθεί από την έγχυση ΝΚ κυττάρων σε ασθενείς με κακοήθεις ασθένειες. Η πρόοδος στη διερεύνηση των υποδοχέων των ΝΚ κυττάρων, οι οποίοι αναστέλλουν ή ενεργοποιούν τη δράση τους [killer cell immunoglobulin-like receptor (KIR), C-type lectins και natural cytotoxicity receptors (NCR)], έδωσε τη δυνατότητα για νέα προσέγγιση στο χειρισμό των αλληλεπιδράσεων των υποδοχέων των ΝΚ κυττάρων με τους αντίστοιχους συνδέσμους, προς όφελος των ασθενών με καρκίνο. Επιπλέον δεδομένα που προέκυψαν από μεταμόσχευση αρχέγονων αιμοποιητικών κυττάρων, μετά από αφαίρεση των Τ λεμφοκυττάρων, από μερικώς συμβατούς δότες (haploidentical ή mismatched) σε ασθενείς με οξεία μυελογενή λευχαιμία (ΟΜΛ), έδειξαν ότι τα αλλοδραστικά ΝΚ κύτταρα, με μη συμβατούς KIR, προστάτευαν από υποτροπή της νόσου, υποδηλώνοντας το θεραπευτικό ρόλο των αλλογενών ΝΚ κυττάρων στην ΟΜΛ.
Με βάση αυτά τα δεδομένα, τα τελευταία χρόνια τα ΝΚ κύτταρα βρίσκονται και πάλι στην αιχμή της διεθνούς ερευνητικής δραστηριότητας με στόχο αφενός την παραγωγή μεγάλου αριθμού διεγερμένων, αυτόλογων ή αλλογενών, ΝΚ κυττάρων για κλινική χρήση (μεταμόσχευση, παθητική μεταφορά), αφετέρου την in vivo ενεργοποίησή τους καθώς και τη χρήση τους σε προ-κλινικές και κλινικές μελέτες για την θεραπεία αιματολογικών κακοηθειών αλλά και στερεών όγκων. Η ικανότητα τους να επάγουν ειδικές ανοσολογικές απαντήσεις σε καρκινικά αντιγόνα τα καθιστά ακόμα πιο ενδιαφέροντα για κλινική χρήση ως «αυτόλογα εμβόλια» κατά του καρκίνου.
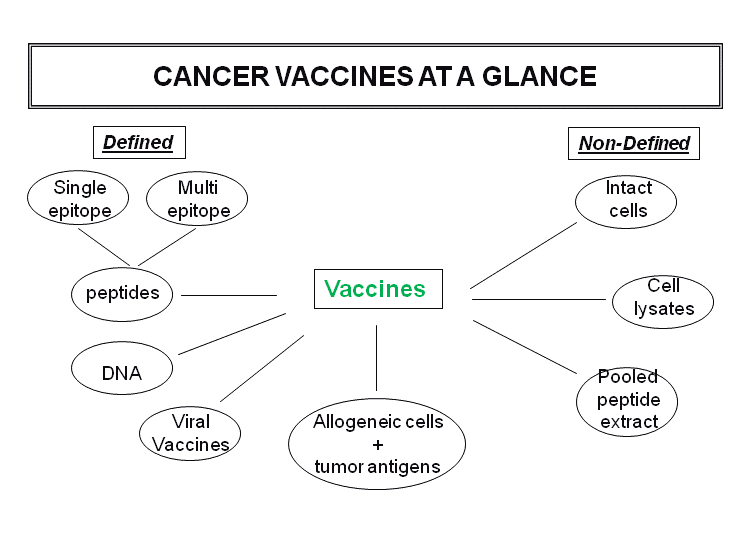
Εμβόλια κατά του καρκίνου (cancer vaccines)
Κύριο βήμα στην πρόοδο της ανοσολογίας την τελευταία δεκαετία ήταν ο καθορισμός της αντιγονικής βάσης της αναγνώρισης και καταστροφής καρκινικών κυττάρων από τα κύτταρα του ανοσολογικού συστήματος. Όπως και τα φυσιολογικά κύτταρα, τα καρκινικά κύτταρα εκφράζουν σύμπλοκα MHC-πεπτιδίων και επομένως, μπορούν να προκαλέσουν ειδικές ανοσολογικές αποκρίσεις περιοριζόμενες από τον απλότυπο του HLA μορίου. Το αποτέλεσμα τέτοιων αποκρίσεων είναι η παραγωγή αντιγονειδικών Τ λεμφοκυττάρων, αλλά και Β λεμφοκυττάρων, ειδικών για τους πεπτιδικούς επιτόπους που προέρχονται από καρκινικά αντιγόνα. Τα καρκινικά αντιγόνα διακρίνονται σε τέσσερεις κατηγορίες: μεταλλαγμένα αντιγόνα (προέρχονται κυρίως από σημειακές μεταλλάξεις, π.χ. β-κατενίνη ή εναλλακτικά επεξεργασμένα αντιγόνα), καρκινικά αντιγόνα όρχεων (cancer-testis antigens, που παράγονται από την επαναδραστηριοποίηση εμβρυϊκών γονιδίων π.χ. NY-ESO-1), αντιγόνα διαφοροποίησης (εκφράζονται σε μεταγενέστερα αναπτυξιακά στάδια από το φυσιολογικό, π.χ. Melan-A/MART-1, gp100) και υπερεκφραζόμενα αντιγόνα (εκφράζονται σε υψηλότερα επίπεδα από ότι στα φυσιολογικά κύτταρα, π.χ. HER-2/neu). Επιπλέον υπάρχουν και ιικά αντιγόνα (π.χ. HBV, HPV, EBV κ.ά) ιών που σχετίζονται άμεσα με την δημιουργία καρκίνου.
Ο εμβολιασμός γίνεται με καρκινικά αντιγόνα, είτε με τη μορφή πεπτιδίων, ολόκληρων πρωτεϊνών ή αδρανοποιημένων καρκινικών κυττάρων κ.λ.π., είτε με την μεταφορά αντιγονο-παρουσιαστικών δενδριτικών κυττάρων «φορτωμένων» με τα καρκινικά αντιγόνα.
Το πρώτο εμβόλιο που πήρε έγκριση από τον FDA μόλις τον Απρίλιο του 2010 είναι το PROVENGE®(Sipuleucel-T) (Dendreon), με ένδειξη ασυμπτωματικούς ή ελάχιστα συμπτωματικούς, ορμονοάντοχους ασθενείς με καρκίνο του προστάτη. Το Sipuleucel-T αποτελεί μια κυτταρική ανοσοθεραπεία που αποτελείται από αυτόλογα δενδριτικά κύτταρα «φορτωμένα» με όξινη προστατική φωσφατάση PAP) ενωμένη με GM-CSF.
Υπάρχουν όμως και πολλά εμβόλια που βρίσκονται σε κλινικές μελέτες φάσης Ι και ΙΙ, αλλά και φάσης ΙΙΙ, όπως η μελέτη της GSK MAGE3 MAGRIT για την πρόληψη της υποτροπής ασθενών με μη μικροκυτταρικό καρκίνο του πνεύμονα, μετά από χειρουργική επέμβαση, ή η μελέτη PRESENT (εμβόλιο HER-2/neu, Neuvax) της Galena Biopharma για την πρόληψη υποτροπής σε υψηλού κινδύνου, ελεύθερους νόσου ασθενείς με καρκίνο του μαστού.
Οι σύγχρονες τάσεις στην ανοσοθεραπεία του καρκίνου περιλαμβάνουν τα εξής:
- Την στόχευση των μηχανισμών διαφυγής από την ανοσοεπιτήρηση, με απομάκρυνση ή εξουδετέρωση των κατασταλτικών παραγόντων.
- Την προηγούμενη ή ταυτόχρονη καταστροφή του περιβάλλοντος τον όγκο «στρώματος» και της νεο-αγγειογένεσης, με χρήση και πάλι του ανοσολογικού συστήματος.
- Ο συνδυασμός της ανοσοθεραπείας με τις κλασσικές κλινικές προσεγγίσεις για την θεραπεία του καρκίνου, δηλαδή την χειρουργική αντιμετώπιση, την χημειοθεραπεία και/ή την ακτινοθεραπεία, αποτελεί την νέα τάση, για δύο κυρίως λόγους:
Ø Πρώτον, με τις μεθόδους αυτές μειώνεται σημαντικά το «φορτίο» του καρκίνου, κάνοντάς τον πιο εύκολο στόχο για την ανοσολογική παρέμβαση.
Ø Δεύτερον, έχει ήδη τεκμηριωθεί ότι ορισμένα χημειοθεραπευτικά φάρμακα απομακρύνουν ή εξουδετερώνουν τους ανοσοκατασταλτικούς μηχανισμούς, ευνοώντας έτσι την θετική ανοσοαπόκριση εναντίον του όγκου.
Σημαντικό επίσης είναι η ανοσοθεραπεία να εφαρμόζεται σε αρχικά στάδια ως «συμπληρωματική» θεραπεία, με τρόπο ανάλογο της «συμπληρωματικής» (adjuvant) χημειοθεραπείας /ακτινοθεραπείας, με στόχο την ολοκληρωτική καταστροφή των καρκινικών κυττάρων και την αποφυγή της μετάστασης.
Ως προς την κλινική εκτίμηση της δράσης των ανοσοθεραπευτικών προσεγγίσεων, φαίνεται ότι σε πολλές περιπτώσεις δεν ισχύουν τα κριτήρια που χρησιμοποιούνται για χημειοθεραπευτικά και άλλα φάρμακα (RECIST criteria). Αυτό οφείλεται στον τρόπο δράσης, δηλαδή την ενεργοποίηση του ανοσολογικού συστήματος, που χρειάζεται χρόνο για την αποτελεσματική της ανάπτυξη (χρόνος κατά τον οποίο μπορεί να υπάρξει ακόμα και παροδική επιδείνωση της νόσου). Επιπλέον η ανοσοθεραπεία μπορεί να οδηγήσει όχι σε εξάλειψη της νόσου, αλλά σε μια σταθερή κατάσταση (stable disease) ανοσολογικής ισορροπίας (equilibrium phase), μετατρέποντας έτσι τον καρκίνο σε μία χρόνια ελεγχόμενη νόσο. Μέχρι σήμερα ο καλύτερος δείκτης αποτελεσματικότητας της ανοσοθεραπείας είναι ο συνολικός χρόνος επιβίωσης (Overall Survival, OS) καθώς και η ποιότητα ζωής (Quality of Life, QoL). Ανοσολογικοί/ βιολογικοί δείκτες μιας έγκαιρης εκτίμησης της πιθανής θετικής ανταπόκρισης στην ανοσοθεραπεία βρίσκονται υπό εντατική διερεύνηση διεθνώς.


